Uszkodzenia nerwów – zarówno tych w mózgu i rdzeniu kręgowym (układ nerwowy centralny), jak i tych w kończynach czy narządach (układ obwodowy) – są jednymi z najbardziej opornych na leczenie urazów biologicznych. O ile układ obwodowy ma pewne, ograniczone zdolności samonaprawy, to o regeneracji centralnego układu nerwowego wciąż możemy mówić raczej w kategoriach science fiction. Sytuację dodatkowo komplikują czynniki takie jak wiek, rozległość urazu czy obecność substancji hamujących procesy naprawcze.
Czytaj też: Regeneracja wzroku stała się faktem. Naukowcy odwracają ślepotę
Tymczasem badania zespołu z Instytutu Weizmanna w Izraelu rzucają zupełnie inne światło na niektóre elementy kodu genetycznego, które dotąd uznawano za bezużyteczne. Odkrycie to może przedefiniować nasze podejście do leczenia uszkodzeń neurologicznych – od urazów po choroby neurodegeneracyjne, jak ALS. Szczegóły opisano w czasopiśmie Cell.
RNA rusza do naprawy neuronów – ale na razie tylko u myszy
Zespół prof. Mike’a Fainzilbera z Wydziału Neurobiologii Molekularnej i Nauk Biomolekularnych odkrył setki cząsteczek RNA, które aktywnie stymulują wzrost aksonów – długich wypustek neuronów odpowiedzialnych za przekazywanie sygnałów. Chodzi o tzw. GI‑SINE (ang. Growth-Inducing Short Interspersed Nuclear Elements) – krótkie, powtarzalne sekwencje niekodującego RNA, należące do większej rodziny B2‑SINE. To cząsteczki, które nie kodują białek, ale regulują aktywność genów i pracę rybosomów.
Czytaj też: Mózg, który regeneruje się sam. Niesamowity lek cofa skutki udaru bez rehabilitacji
Dotąd ignorowane jako bezużyteczne elementy genomu, GI‑SINE okazują się być aktywowane po urazie nerwu i uruchamiają molekularny “program naprawczy” komórki nerwowej. Ich mechanizm działania jest trójtorowy: są aktywowane przez czynniki transkrypcyjne AP‑1 (odpowiadające na stres komórkowy), wiążą się z rybosomami i białkiem nukleoliną, a następnie przesuwają produkcję białek niezbędnych do regeneracji z końcówki aksonu bliżej jądra komórkowego.
Badania prowadzono zarówno na modelach uszkodzenia nerwu kulszowego (układ obwodowy), jak i uszkodzenia nerwu wzrokowego oraz drogi korowo-rdzeniowej (układ centralny). W pierwszym przypadku regeneracja zachodziła naturalnie, ale była wyraźnie przyspieszona przez obecność GI‑SINE. W drugim komórki nerwowe same z siebie nie aktywowały GI‑SINE. Dopiero po ich sztucznej ekspresji z wykorzystaniem terapii genowej, neurony siatkówki i mózgu zaczęły odtwarzać uszkodzone aksony.
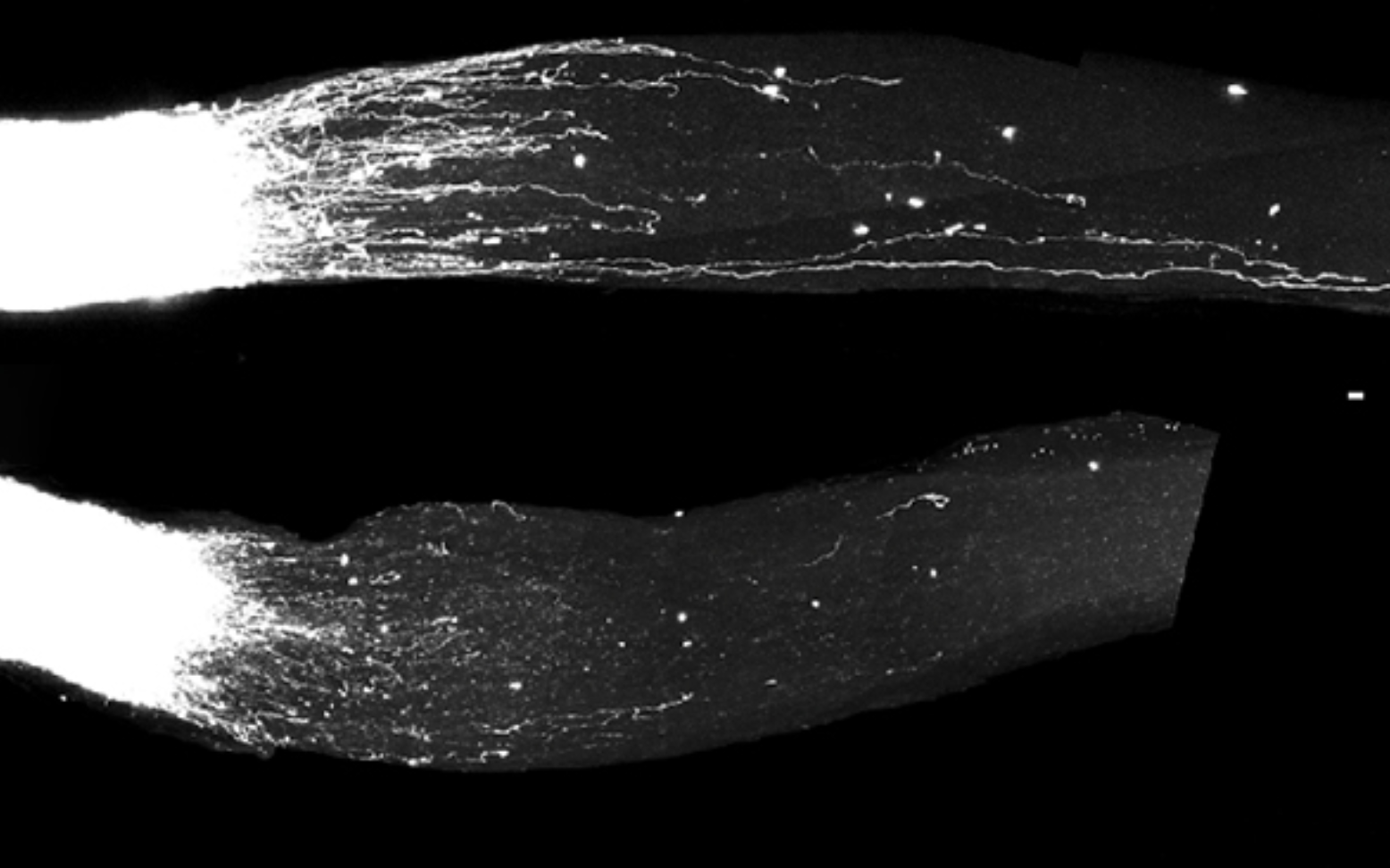
Choć nie doprowadziło to jeszcze do pełnej regeneracji funkcjonalnej, sam fakt pobudzenia wzrostu neuronów centralnego układu nerwowego to istotny przełom.
Jak podkreśla prof. Fainzilber, badania nie dowodzą jeszcze, że GI‑SINE mogą przywracać pełną funkcję uszkodzonych nerwów. Wiadomo jednak, że cząsteczki te łączą się z białkami odpowiedzialnymi za syntezę i mogą wpływać na inne, jeszcze niezidentyfikowane szlaki molekularne. Najważniejsze ograniczenie? Badania przeprowadzono na myszach. Choć w genomie człowieka istnieją podobne sekwencje RNA – tzw. elementy Alu – dopiero teraz rozpoczynają się badania ich funkcjonalnych odpowiedników u ludzi.
Zespół naukowców już testuje terapie mające naśladować działanie B2‑SINE w regeneracji nerwów uszkodzonych przez cukrzycę, urazy mechaniczne czy udar mózgu. Trwają też wspólne projekty z UCLA, Uniwersytetem w Tel Awiwie, Uniwersytetem Hebrajskim i Sheba Medical Center nad potencjalnym zastosowaniem w leczeniu stwardnienia zanikowego bocznego (ALS).
