W najnowszych badaniach opublikowanych w czasopiśmie Blood, zespół badaczy z Hubrecht Institute, Erasmus MC i Sanquin przedstawił koncepcję, która może zrewolucjonizować terapię genową. W centrum ich zainteresowania znalazł się problem uśpionych genów – takich, które w czasie rozwoju płodowego były aktywne, ale po urodzeniu zostały wyłączone. W normalnych warunkach ich wyciszenie ma sens biologiczny, jednak w kontekście chorób genetycznych ich ponowna aktywacja mogłaby pełnić funkcję “koła ratunkowego”.
Czytaj też: Nowy rozdział w medycynie. Pierwszy na świecie pacjent leczony spersonalizowaną terapią CRISPR
Zamiast wprowadzać nowe geny, zmieniać ich sekwencję czy dodawać sztuczne regulatory, naukowcy zastosowali inną strategię: skrócili fizyczną odległość między genem a jego enhancerem – sekwencją DNA, która reguluje jego aktywność. Dokonali tego przy użyciu systemu CRISPR/Cas9, który działa jak precyzyjne nożyczki molekularne.
Dr Anna-Karina Felder z Hubrecht Institute mówi:
W tym badaniu odkryliśmy, że możliwe jest aktywowanie genu poprzez zbliżenie go do enhancera. Skierowaliśmy CRISPR/Cas9 tak, by wyciął fragment DNA pomiędzy enhancerem a uśpionym genem. W rezultacie te dwa elementy znalazły się bliżej siebie, co skutecznie reaktywowało gen.
Jak skrócić dystans między genem a enhancerem?
Nowa metoda została przetestowana w kontekście dwóch poważnych chorób genetycznych krwi: anemii sierpowatej i β-talasemii. Oba schorzenia wynikają z defektów w genie kodującym dorosłą formę hemoglobiny – białka odpowiedzialnego za transport tlenu w organizmie. W wyniku mutacji hemoglobina przestaje działać prawidłowo, co skutkuje poważnymi konsekwencjami zdrowotnymi: chroniczną anemią, zmęczeniem, bólami, a nawet uszkodzeniem narządów. Chorzy często są uzależnieni od regularnych transfuzji krwi.
Czytaj też: CRISPR/Cas9, komórki tłuszczowe i głodujące nowotwory. Pomysłowa metoda walki z rakiem
Co ciekawe, organizm posiada tzw. płodową wersję genu globiny, która działa przed narodzinami, a potem zostaje naturalnie wyciszona. U osób zdrowych to logiczne – wersja dorosła działa lepiej w warunkach życia pozamacicznego. Ale u chorych, u których dorosły gen jest uszkodzony, ta “rezerwowa” wersja mogłaby pełnić funkcję kompensacyjną. Kluczem jest jej ponowne uaktywnienie – i właśnie to udało się osiągnąć dzięki technologii “delete-to-recruit”.
Dr Anna-Karina Felder dodaje:
Płodowa globina to jak silnik zapasowy. Jeśli główny napęd, czyli dorosły gen hemoglobiny, zawodzi, wystarczy uruchomić ten rezerwowy. Dzięki temu możemy przywrócić zdolność czerwonych krwinek do transportu tlenu – być może na zawsze.
Enhancery – choć mogą być położone bardzo daleko od kontrolowanego przez nie genu – działają jak swoiste włączniki. Są fragmentami DNA, które nie kodują białek, ale decydują o tym, czy gen obok nich zostanie aktywowany. W przypadku płodowej globiny, enhancer leży w sporej odległości od samego genu. W komórkach dorosłych ta odległość sprawia, że gen nie działa.
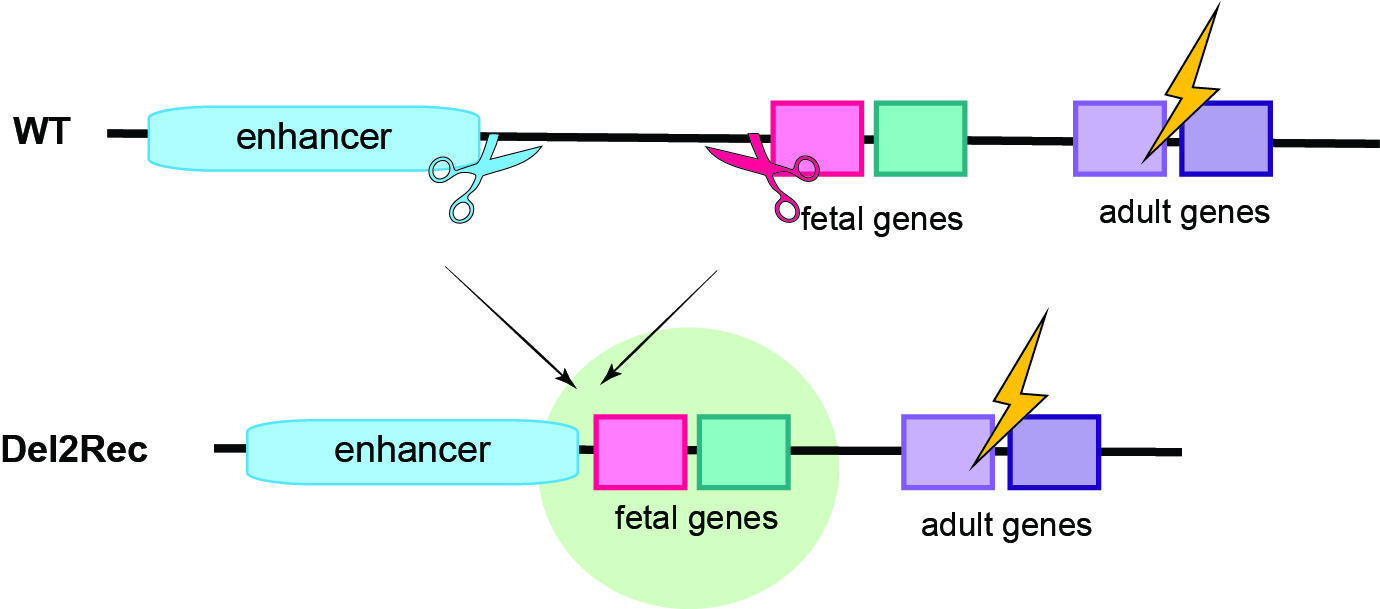
Zespół Felder zastosował CRISPR/Cas9 do wycięcia segmentu DNA między enhancerem a genem płodowej globiny. To tak, jakby skrócić ścieżkę między włącznikiem a lampką. Gdy dystans zmalał – gen znów się uruchomił. I, co kluczowe, stało się to w komórkach macierzystych krwi, które potem w naturalny sposób dają początek zdrowym, funkcjonalnym erytrocytom.
Eksperymenty przeprowadzono zarówno na komórkach od zdrowych dawców, jak i pacjentów z anemią sierpowatą. Współpraca z zespołami z Erasmus MC oraz Sanquin pozwoliła na potwierdzenie działania techniki w warunkach maksymalnie zbliżonych do klinicznych.
Obecnie dostępne terapie genowe dla anemii sierpowatej – choć skuteczne – są bardzo kosztowne i ingerują w tzw. represor płodowej globiny, co niesie ryzyko niepożądanych efektów ubocznych. Metoda “delete-to-recruit” omija te problemy. Nie wprowadza nowych genów, nie modyfikuje sekwencji regulatorowych, nie ingeruje w inne części genomu. Po prostu – zmienia fizyczną architekturę DNA.
To nie tylko bezpieczniejsze, ale i znacznie tańsze. Nie trzeba projektować nowych nośników wirusowych ani skomplikowanych terapii personalizowanych. Potencjalnie, technologia ta może stać się podstawą ogólnodostępnej terapii genowej dla chorób dziedzicznych – nie tylko tych związanych z krwią.
