W laboratorium Center for Genomic Regulation (CRG) w Barcelonie dokonano jednego z najbardziej zaskakujących odkryć ostatnich lat w onkologii eksperymentalnej. Zespół badaczy pod kierunkiem dr Sary Sdelci zastosował mikroskop zdolny do fizycznego kompresowania komórek nowotworowych – zaledwie do trzech mikrometrów szerokości. To tak, jakby próbować przecisnąć człowieka przez szczelinę grubości nitek DNA.
Czytaj też: Egzosomy kontra rak płuca. Nowatorski projekt z Wrocławia może zmienić terapię onkologiczną
Mitochondria utworzyły wokół jądra komórkowego tak ciasny pierścień, że jego powierzchnia zapadła się do środka. To zjawisko zaobserwowano aż w 84 proc. ściśniętych komórek nowotworowych linii HeLa, podczas gdy w komórkach swobodnie pływających, niepoddanych naciskowi, praktycznie nie występowało. Naukowcy nazwali tę strukturę NAMs (nucleus-associated mitochondria), czyli mitochondria powiązane z jądrem.
Dr Sara Sdelci mówi:
To odkrycie zmusza nas do przewartościowania roli mitochondriów w organizmie. Nie są to bierne źródła energii, ale dynamiczne jednostki pierwszego reagowania, które można przywołać w chwilach ekstremalnego zagrożenia.
Dlaczego komórki rakowe muszą się przeciskać?
Choć może brzmieć to abstrakcyjnie, komórki nowotworowe nie siedzą w miejscu. W procesie inwazji na inne tkanki – czyli metastazy – muszą nieustannie przeciskać się przez gęste i ciasne środowiska: szczeliny międzykomórkowe, wąskie naczynia włosowate, a także zbite strefy tkanki guza. Każde takie “przejście” grozi uszkodzeniem błon i DNA komórki. Tymczasem zdolność do natychmiastowej naprawy tych uszkodzeń może decydować o tym, która komórka przetrwa i utworzy przerzut.
Czytaj też: Odpoczynek zamiast ataku. Nowatorski sposób walki z rakiem
W biopsjach guzów piersi pobranych od 17 pacjentek badacze zaobserwowali wyraźną korelację: komórki na obrzeżach guza – tam, gdzie dochodzi do kontaktu z otaczającą tkanką – znacznie częściej wykazywały tworzenie NAMs niż te w centrum zmiany nowotworowej. Wyjaśnienie? Jak mówi Ritobrata Ghose, współautor badania:
Środek guza jest gęsty, ale względnie stabilny. Natomiast jego obrzeże to dynamiczna strefa walki o przetrwanie – tu komórki muszą się szybko adaptować, by przebić się przez barierę tkankową i rozpocząć przerzut.
Żeby jednak mitochondria mogły zorganizować się wokół jądra i skutecznie produkować ATP, potrzebne jest wewnętrzne “rusztowanie” komórki. Tu kluczową rolę odgrywają filamenty aktynowe – mikroskopijne włókna, które tworzą siateczkę umożliwiającą przytwierdzenie mitochondriów w odpowiednim miejscu.
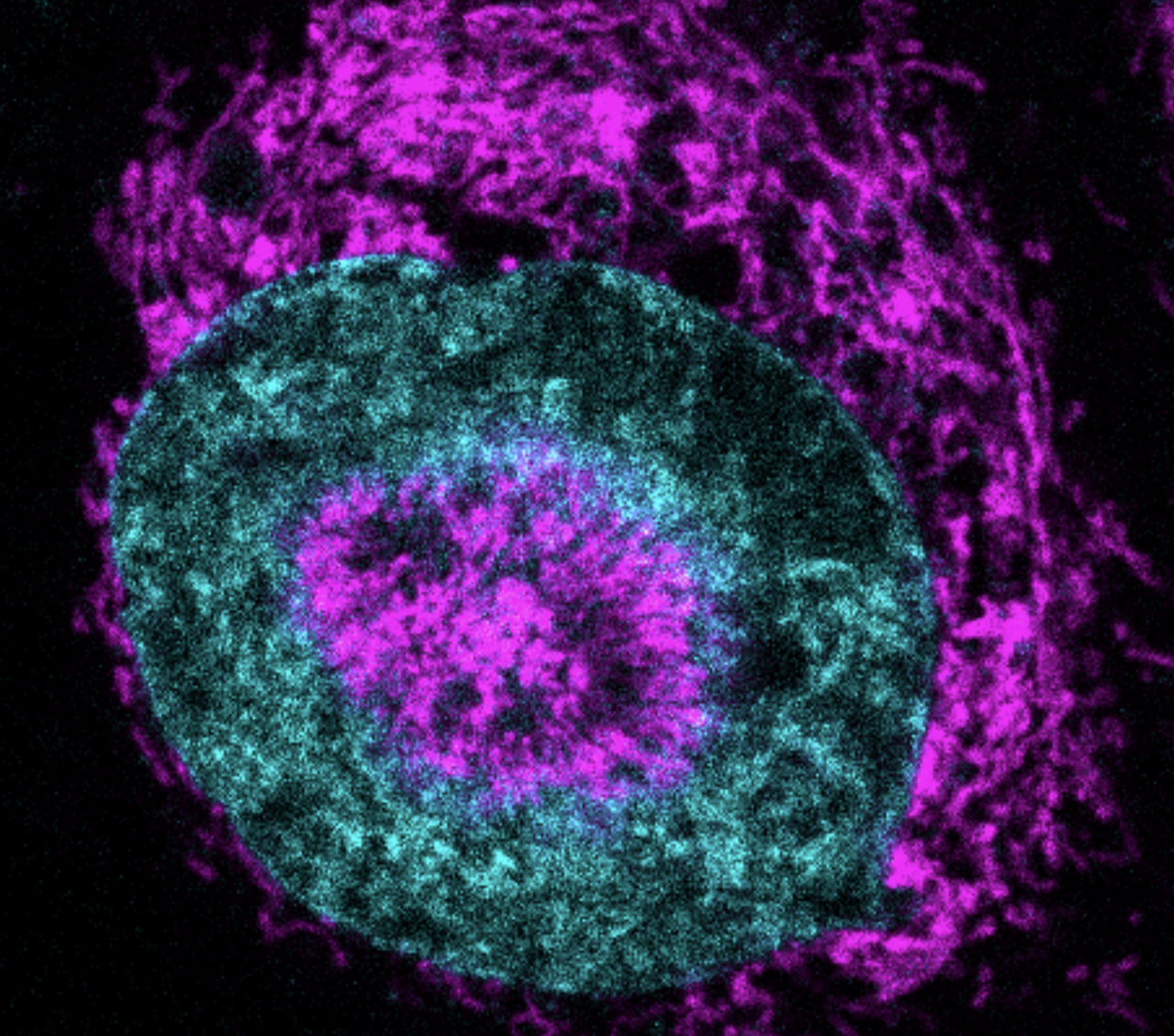
Zespół z Barcelony wykazał, że gdy potraktowano komórki środkiem farmakologicznym rozkładającym aktynę, NAMs uległy całkowitemu rozpadowi. Oznacza to, że integralność cytoszkieletu – często pomijana w badaniach onkologicznych – może być kluczowym czynnikiem warunkującym przeżywalność komórek raka w ekstremalnych warunkach mechanicznych.
Choć NAMs wydają się być imponującą strategią adaptacyjną, stanowią zarazem nowy potencjalny cel terapeutyczny. Jeśli udałoby się opracować leki zakłócające ten mechanizm – czy to przez destabilizację aktyny, czy blokadę przemieszczania mitochondriów – komórki nowotworowe mogłyby stracić zdolność do szybkiej naprawy DNA. A to oznaczałoby ich większą podatność na chemioterapię, radioterapię czy immunoterapię, które opierają się na wywoływaniu uszkodzeń genetycznych.
Choć badania opisane w Nature Communications dotyczyły komórek nowotworowych, ich autorzy podkreślają, że odkryty mechanizm może mieć uniwersalny charakter. Podobnym siłom mechanicznym podlegają bowiem także inne komórki organizmu, na przykład komórki układu odpornościowego przeciskające się przez węzły chłonne, neurony tworzące wypustki czy komórki zarodkowe podczas kształtowania tkanek. W takich warunkach fizycznego stresu komórki mogą wykorzystywać zastrzyk energii w obrębie jądra, by chronić integralność swojego DNA. To odkrycie wprowadza nową warstwę regulacji w biologii komórki i zmienia nasze rozumienie tego, jak komórki przystosowują się do ekstremalnych obciążeń mechanicznych.
