Zespół badaczy z Niemieckiego Centrum Badań nad Zakażeniami (DZIF) przy Uniwersyteckim Szpitalu w Heidelbergu zidentyfikował wcześniej nieopisaną zasadę wyboru miejsc, w które HIV-1 “wpina” swój materiał genetyczny po zakażeniu. Okazuje się, że wirusowa integraza – enzym odpowiedzialny za włączenie DNA HIV do DNA gospodarza – kieruje się obecnością hybryd RNA:DNA zwanych pętlami R.
Czytaj też: Przełom w walce z HIV. Dwa zastrzyki rocznie dają 100 procent ochrony
To lokalne struktury powstające w genach aktywnie przepisywanych na RNA; właśnie tam wirus najchętniej urządza sobie bezpieczną kryjówkę. Wnioski opisane w Nature Microbiology są kluczowe, bo tłumaczą uporczywość rezerwuarów HIV, które przetrwają nawet przy doskonale prowadzonej terapii i odradzają się po przerwach w leczeniu.
Pętle R jako “znaki drogowe” dla HIV, Aquarius jako “pomocnik”
Autorzy połączyli mapowanie miejsc integracji z biochemią i inżynierią komórkową. W pierwotnych ludzkich limfocytach CD4+ wykazali, że szczyty pętli R przypadają na introny aktywnie transkrybowanych genów – dokładnie te regiony, które HIV trafia najczęściej. Co więcej, integraza HIV bezpośrednio wiąże pętle R, a ich “rozsupływanie” sprzyja samej reakcji integracji in vitro.
Czytaj też: Przełom w walce z HIV. Lek onkologiczny EBC-46 jako klucz do eliminacji wirusa
W tym punkcie na scenę wchodzi helikaza RNA Aquarius (AQR), enzym komórkowy związany z obróbką RNA. Niemieccy naukowcy pokazali, że AQR fizycznie współpracuje z integrazą i ułatwia integrację w hybrydach RNA:DNA; po wyłączeniu AQR w komórkach całkowita efektywność integracji spadała, a nieliczne pozostałe zdarzenia przesuwały się do rejonów ubogich w pętle R i częściej poza genami. To mocny, eksperymentalny dowód, że pętle R są dla HIV “znakami drogowymi”, a AQR jednym z przewodników, które prowadzą wirusa do najbardziej “gościnnych” zakątków genomu.
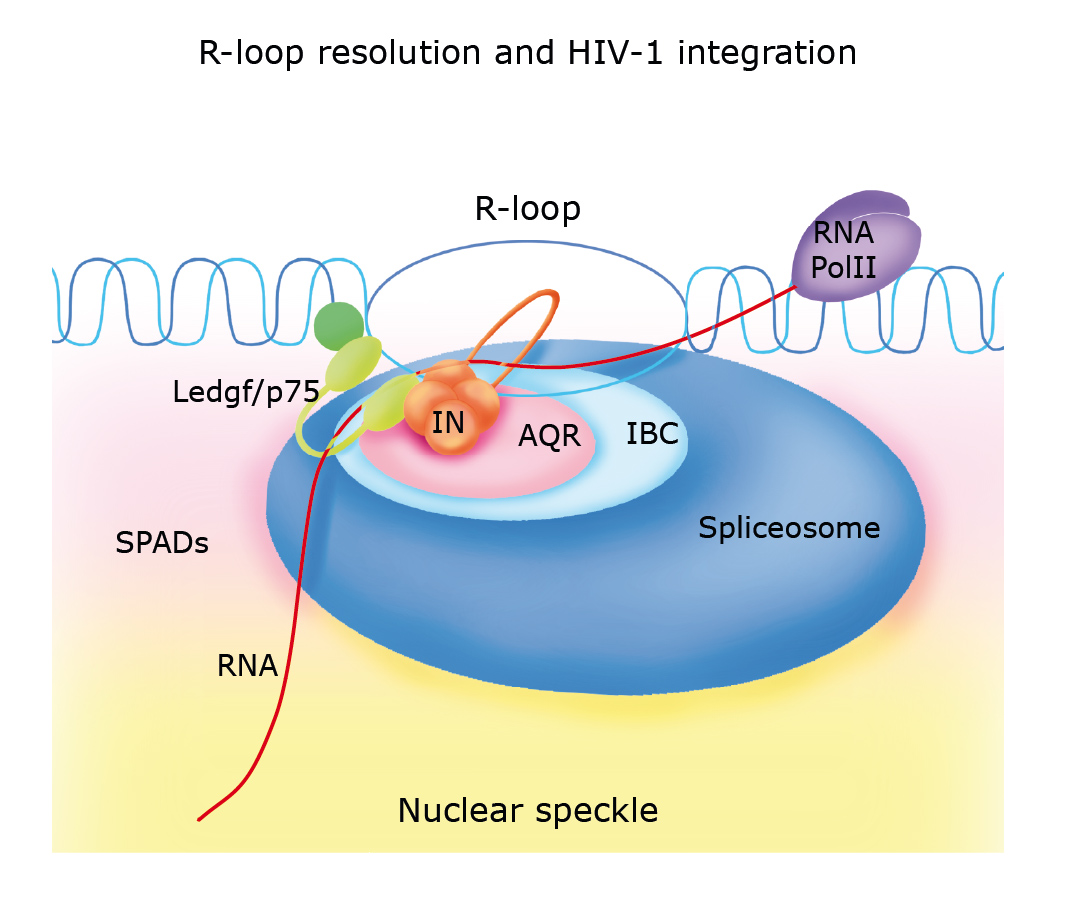
Integracja to krok, który czyni zakażenie przewlekłym: od tej pory komórka kopiuje prowirusa wraz z własnymi genami, a HIV może trwać w uśpieniu i aktywować się w sprzyjających warunkach. Dlatego, mimo że nowoczesna terapia antyretrowirusowa (ART) potrafi utrzymać wiremię poniżej progu wykrywalności i wydłużyć życie do poziomu zbliżonego do populacyjnego, pacjenci muszą przyjmować leki stale. Przerwy – spowodowane choćby problemami z dostępnością – dają rezerwuarom czas na odrodzenie i zwiększają ryzyko oporności.
Poznanie reguł, według których wirus zakłada te kryjówki, otwiera nowy front terapeutyczny: blokując interakcję integrazy z pętlami R lub modulując aktywność AQR, można ograniczyć liczbę “dobrze ulokowanych” prowirusów i w perspektywie zmniejszyć zależność od codziennego ART. To właśnie sedno koncepcji funkcjonalnego wyleczenia – stanu, w którym wirus pozostaje pod trwałą kontrolą bez ciągłych leków.
Krok w stronę funkcjonalnego wyleczenia
W badaniu naukowcy zastosowali sekwencjonowanie nowej generacji (NGS), aby z dużą precyzją namierzyć miejsca przyłączania wirusowego DNA w genomie gospodarza i porównali wzorce integracji między różnymi próbkami. Dane potwierdziły, że HIV nie wybiera przypadkowo: preferuje regiony otwartej chromatyny i introny aktywnych genów, a obecność pobliskich hybryd RNA:DNA wzmacnia to ukierunkowanie.
Czytaj też: HIV wykrywane zbyt późno. Czy testy w POZ to zmienią?
Trzeba też pamiętać, że pętle R nie są “wynalazkiem” wirusa, tylko elementem zwykłej pracy komórki. Uczestniczą w regulacji genów, a ich nadmiar bywa związany z niestabilnością genomu. Oznacza to, że farmakologiczne manipulacje muszą być wyjątkowo precyzyjne, tak by nie rozregulować fizjologii transkrypcji. Podobnie z AQR – to enzym gospodarza zaangażowany w obróbkę RNA; jego globalne hamowanie mogłoby być toksyczne. Najbardziej obiecujące mogą więc okazać się cząsteczki, które selektywnie zaburzają kontakt integrazy z hybrydą RNA:DNA lub jej lokalną dynamikę w “ulubionych” przez HIV intronach. To nie jest droga na skróty do sterylizującego wyleczenia, ale logiczny, mechanistyczny krok w stronę funkcjonalnego opanowania zakażenia.
Na świecie z HIV żyje ok. 40,8 mln osób, a 31,6 mln korzysta z terapii. Mimo ogromnego postępu nadal co roku dochodzi do ponad miliona nowych zakażeń, a setki tysięcy ludzi umierają z przyczyn związanych z HIV. W ostatnich latach łańcuchy dostaw leków i finansowanie programów bywały kruche, co bezpośrednio przekłada się na przerwy w leczeniu i wzrost ryzyka oporności. Dlatego mechanizmy, które potencjalnie pozwolą ograniczyć zależność od codziennych dawek, mają znaczenie nie tylko naukowe, ale i strategiczne dla globalnego zdrowia.
